
文 | 合规部&杨国君
受新冠病毒肺炎疫情影响,日前,《欧洲议会正式公报》发布(EU) 2020/561法规,采纳了European Commission (欧盟委员会)的提案,对医疗器械法规MDR (EU) 2017/745进行了修订,将MDR的执行日期从2020年5月26日推迟到2021年5月26日,并对其他规定的执行日期也做了相应调整。

在2017年5月5日欧盟正式发布了新版医疗器械法规MDR(EU) 2017/745。
2017年5月25日,MDR正式生效。对于向欧盟销售医疗器械的制造商来说,这标志着MDR过渡期已开始。医疗器械指令MDD(93/42/EEC)和有源植入医疗器械指令AIMDD(90/385/EEC)被医疗器械法规MDR(EU)2017/745取代,法规过渡期设为3年,2020年5月26号将强制执行(现延期至2021年5月26日生效)。
也就是说从2021年5月26日, MDR指令在欧盟就将开始强制执行,它将完全取代过去老的医疗器械指令MDD (93/42/EEC)和老的有源植入医疗器械指令AIMDD(90/385/EEC)。


特别需要指出的是:
●当前没有CE证书的产品,自2021年5月27日起,必须按照MDR认证;
●2021年5月26前签发的MDD证书,在有效期内仍然可以用;
●原有MDD证书需在证书失效前换发 MDR。
企业在申请CE认证时,在过渡阶段请谨慎考虑是选用最新法规还是采用老的指令方案,同时也需要对NB机构的发证资格进行了解和确认以保证产品在欧盟市场销售的可延续性。
关于个人防护口罩和医用口罩的CE证书认证资格的鉴别可见:
COVD-19疫情全球蔓延,欧洲目前仍然是抗疫主战场,防护类物资紧缺。目前我们可以代办德国最大的检验检测认证机构,向德国安全认证技术中心(ZLS)提出的临时快速检测及符合性声明流程,相比传统CE认证耗时数月,快速检测流程将大大缩短。
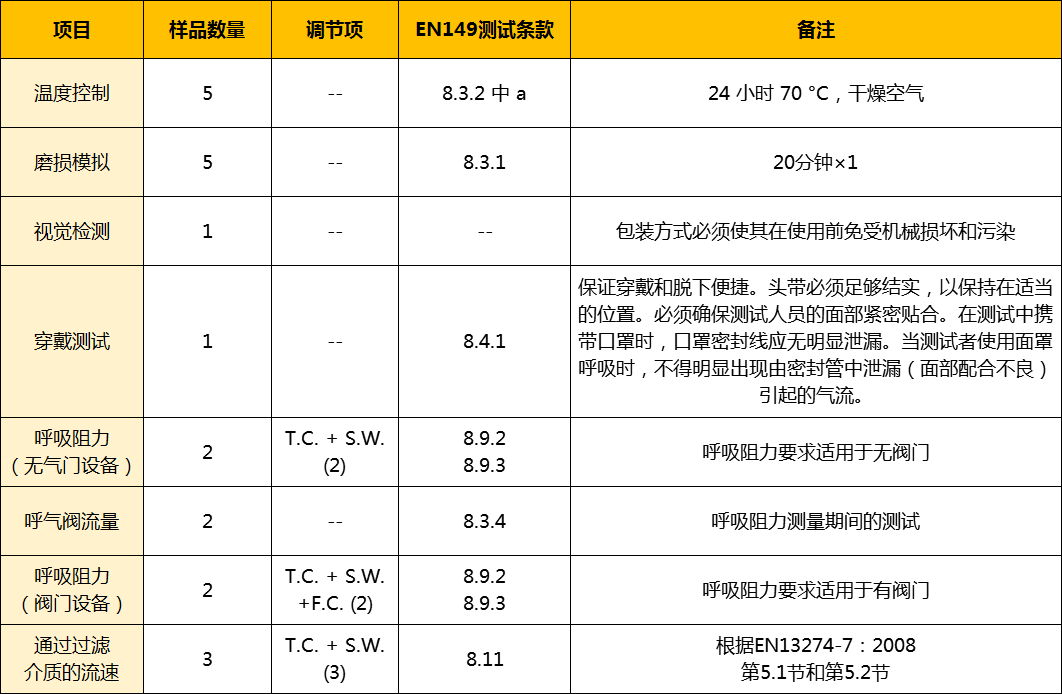
认证范围
适用于与SARS-CoV-2新型冠状病毒有关的呼吸面罩(CPA)的最低要求和测试程序。根据这一测试原则测试的CPA不按照PPE条例(E U)2016/425归类为个人防护设备。对于根据EN 149:2001+A1:2009通过检测并依据PPE法规(欧盟)2016/425获得批准,这些CPA仍不应被视为等同于通过了检查, 这一原则仅作为建议的一部分,用于控制SARS-CoV-2新型冠状病毒疫情的影响采取的行动,指的是“欧盟委员会2020年3月13日关于COVID-19威胁范围内的合格评估和市场监督程序的第2020/403号建议”。
具体事项与我们联系
出口防疫用品合规
杨先生
电话:021-65756675-8005

