
科普贴——CE证书认证资格的鉴别
随着新冠肺炎疫情在全球的蔓延,欧美国家从之前的围观状态,发展成了现在的疫情重灾区。全世界范围防疫物资的告急使得中国制造成了全世界人民群众的期盼。但是想要产品顺利出口到欧盟市场,那么CE认证就必不可少。目前在市场上也出现了五花八门的CE认证证书,让人眼花缭乱。

一、个人防护
为了更好地让大家了解CE证书的真伪,今天教大家具体的鉴别方式。我们可以通过您手上的证书的发放机构入手,在欧盟官网查询,看它是否具备欧盟医疗器械指令MDD 93/42/EEC或MDR医疗器械法规(EU) 2017/745的认证资质。
(知识扩展:2017年5月,欧盟委员会提出了新的医疗器械法规,参考法规(EU)2017/745(以下简称:MDR2017/745)。通过更换现行的医疗器械指令(MDD)93/42/ EEC,该新法规将从2020年开始全面有效。虽然2020年05月26号MDR强制实施,并不意味着2020年05月26号之后,按照原93/42/EEC指令颁布的MDD证书失效,但是所有按照原93/42/EEC指令颁布的MDD证书将会于2024年05月27日失效,所以2024年05月27日是一个截止日期。)
认证机构有很多,且他们都是被欧盟认可的,但是每个认证机构都有自己所被授权的领域。具体来说如果你想出口口罩,那么就要找含有“医疗器械设备”或“个人防护设备”的领域的认证机构。只有具备的完整的Module B、C2和(或)D的资质的公告机构,所签发的认证证书才是有效证件!
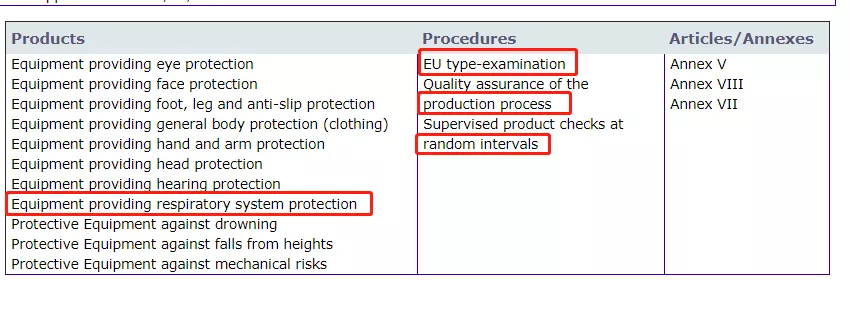
EU type-examination = Module B
Production process = Module C2
Random intevals =Module D
只有在获得Module B+Module C2证书或Module B+Module D证书后,才可以进入欧盟市场合法销售。若公告机构只有部分授权,那么所签发的证书也是无效的!
二、医用口罩
如果是医用口罩,则需要按医疗器械法规完成认证。而对于医用口罩来说,则需要进一步确认它是否无菌。
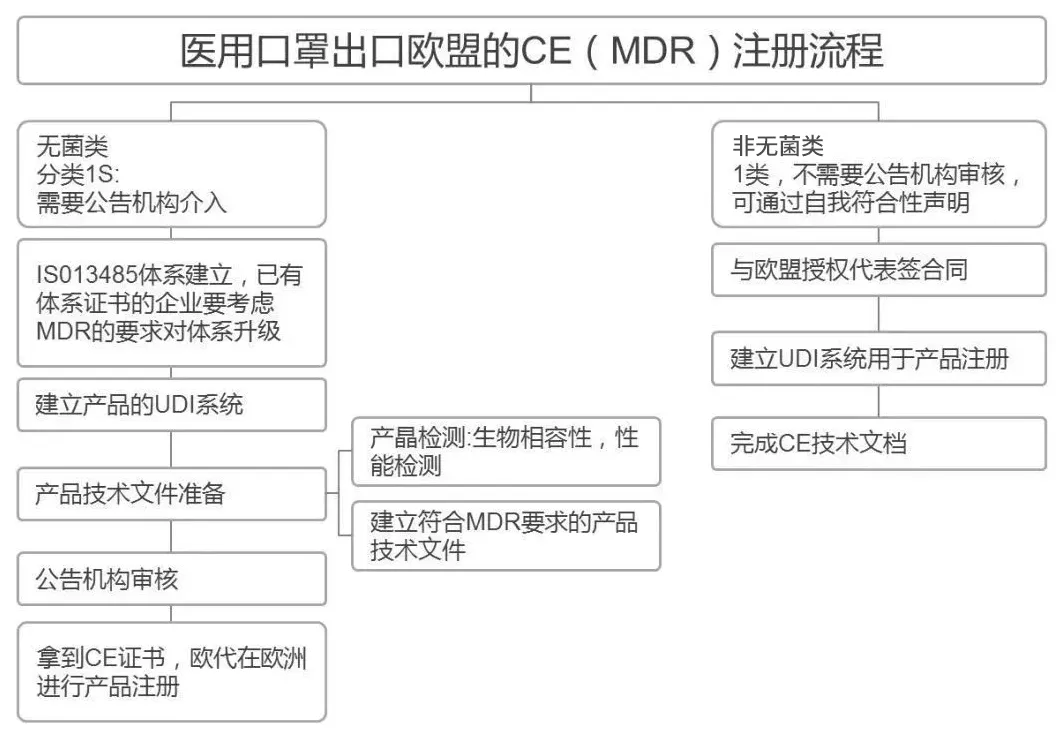
如果是无菌医用口罩,在欧盟属于一类带灭菌医疗产品,必须按照医疗器械指令/法规MDD/MDR进行CE认证,这类情况是一定需要有授权的公告机构参与的。
如果是非无菌医用口罩,则是按照医疗器械指令/法规MDD/MDR进行CE自我宣称,企业不需要通过公告机构认证,在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。